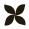Czym jest neurogeneza i gdzie zachodzi?
Neurogeneza to proces kilkuetapowy, który zachodzi w dwóch strukturach mózgu: hipokampie i opuszkach węchowych. Hipokamp (hippocampus) położony jest w centralnej części mózgu pod wzgórzem (thalamus) i odpowiada głównie za pamięć. Opuszka węchowa (bulbus olfactorius) zaś leży u podstawy przedniej części mózgu i umożliwia rozpoznawanie zapachów. Przypuszcza się, że neurony mogą też powstawać w innych obszarach mózgu, ale nie zostało to jeszcze potwierdzone.
Elementy układu limbicznego mózgu. Na niebiesko oznaczone są miejsca, w których zachodzi neurogeneza, czyli hipokamp i opuszka węchowa. Układ limbiczny odpowiedzialny jest za emocje, motywację i pamięć. Źródło: pinterest.com
Neurogeneza odbywa się przez całe nasze życie, ale w różnym natężeniu – naturalnie zwalnia na przykład w wieku podeszłym. Istnieją czynniki, które mogą ją spowolnić lub przyspieszyć, o których opowiem później. Dawniej sądzono, że mózg rozwija się jedynie w okresie prenatalnym i że w dojrzałym mózgu neurogeneza nie zachodzi. Dosyć długo uważano, że człowiek rodzi się z określoną liczbą komórek nerwowych i w ciągu życia może je tylko tracić bez szansy na odbudowę. Tezę tę głosił słynny hiszpański neuroanatom i noblista w dziedzinie medycyny – Santiago Ramón y Cajal, który zajmował się strukturą układu nerwowego. Dopiero w latach 60. XX wieku pojawiły się pierwsze obserwacje podziałów i powstawania komórek nerwowych, ale jeszcze zbyt niejasne, aby można było wysnuć konkretne wnioski. Zainspirowały one jednak wielu badaczy i doprowadziły do przeprowadzenia eksperymentów, które w 1998 roku zakończyły się publikacją dowodów na istnienie neurogenezy w dorosłym mózgu.
Neurogeneza a neuroplastyczność
Warto podkreślić, że neurogeneza nie jest tym samym co neuroplastyczność, ale oba te procesy są ze sobą powiązane. Neuroplastyczność to zdolność mózgu to tworzenia i modyfikowania połączeń między komórkami nerwowymi, inaczej mówiąc do reorganizacji własnej struktury. Zachodzi np. wtedy, gdy uczymy się czegoś nowego. Neurogeneza natomiast obejmuje wyłącznie powstawanie nowych komórek nerwowych. Aby proces neurogenezy stał się kompletny, musi zajść neuroplastyczność, czyli połączenie nowo powstałych neuronów z innymi. Natomiast aby zaszła neuroplastyczność, nie zawsze są potrzebne nowe komórki – nowe połączenia lub ich modyfikacja mogą zachodzić pomiędzy tymi neuronami, które już istnieją. Dzięki neurogenezie i plastyczności mózgu jesteśmy w stanie uczyć się i zapamiętywać, adaptować do nowych warunków otoczenia, zmieniać nasze nawyki i przyzwyczajenia oraz wykształcać nowe. O neuroplastyczności i technikach jej poprawiania pojawi się osobny artykuł :)

Źródło: https://www.nicabm.com/brain-how-does-neuroplasticity-work/
Neurogeneza:
- ciągłe generowanie nowych neuronów w określonych obszarach mózgu
Neuroplastyczność:
- tworzenie nowych połączeń (synaps) między neuronami
- wzmacnianie połączeń
- osłabianie połączeń
Etapy neurogenezy
Do wytworzenia nowych komórek nerwowych potrzebne są neuronalne komórki macierzyste (NSC – neuronal stem cells). Mają one zdolność do niekończącego się podziału, czyli proliferacji, oraz do różnicowania. A zatem najpierw z komórek macierzystych powstają kolejne komórki macierzyste, a następnie z powstałych komórek macierzystych na drodze różnicowania powstają specyficzne komórki nerwowe: neurony, czyli podstawowe komórki nerwowe odpowiadające za przewodzenie impulsów, oraz astrocyty i oligodendrocyty – czyli komórki glejowe, które otaczają neurony, podpierając je i chroniąc.
Aby zaszło różnicowanie, potrzebne są tzw. czynniki wzrostu. Jest ich kilka, a na ich aktywność wpływają różne czynniki zewnętrzne, np. dieta, aktywność fizyczna, bodźce z otoczenia czy uszkodzenia mózgu. Czynniki wzrostu wpływają na to, w jakie komórki przekształcają się komórki macierzyste, a potem nadają kierunek powstającym między nimi aksonom, czyli włóknom nerwowym przekazującym impulsy nerwowe z jednego neuronu do drugiego.
Część wykształconych komórek nerwowych umiera, a te, które przeżyły, przemieszczają się tam, gdzie są potrzebne i integrują się z resztą mózgu. Cały proces neurogenezy można zatem podsumować następująco:
- podział komórek macierzystych,
- różnicowanie się wytworzonych komórek macierzystych pod wpływem czynników wzrostu,
- obumieranie części wytworzonych komórek,
- migracja i integracja neuronów, które przeżyły.
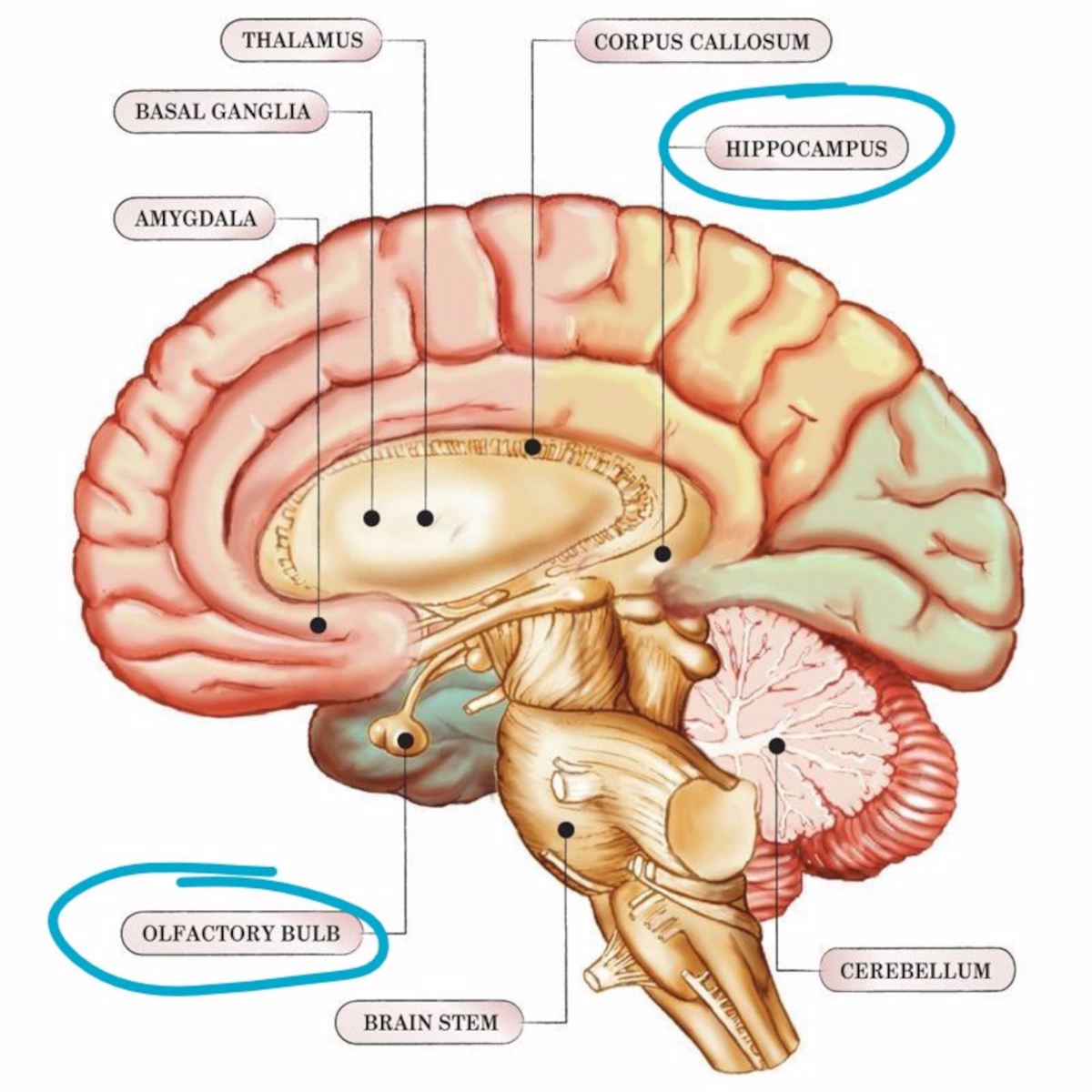
Źródło: https://www.analytica-world.com/en/news/1156404/why-are-neuron-axons-long-and-spindly.html
Budowa neuronu:
- Soma (ang.) – ciało komórki nerwowej.
- Dendrites – dendryty, czyli wypustki neuronu. Przewodzą bodźce do ciała komórki nerwowej.
- Axon – akson, czyli tzw. włókno nerwowe. Przekazuje impulsy z ciała komórki do innych neuronów.
- Axon terminals – zakończenia aksonu.
Czynniki wpływające na neurogenezę
Istnieje wiele czynników, które hamują lub stymulują neurogenezę. Na niektóre z nich nie mamy wpływu, ale gdy skupimy się na tych, na które możemy wpływać, jesteśmy w stanie mocno ograniczyć negatywny efekt tych, na które nie możemy wpływać.
Warto dodać, że czynniki podnoszące tempo neurogenezy nie tylko promują rozwój naszego mózgu, ale mogą też pozytywnie wpływać na mózg dotknięty chorobą neurodegeneracyjną (demencja, Alzheimer, Parkinson). Coraz częściej stosuje się je w terapii takich chorób, aby opóźnić postęp neurodegeneracji i jak najdłużej zachować funkcje kognitywne [1, 3, 5].
Wewnętrzne czynniki wpływające na neurogenezę
Wiek
Jak już wyjaśniłam wcześniej, neurogeneza zachodzi przez całe nasze życie. Zmienia się tylko jej tempo – u młodych ssaków podział neuronalnych komórek macierzystych zachodzi znacznie szybciej niż u starszych. Znaczenie ma też przeżywalność nowych komórek nerwowych, która jest wyższa w młodości [1]. Z tego powodu dzieci uczą się i rozwijają intelektualnie szybciej niż osoby starsze i są w stanie przyswoić więcej informacji, które zapamiętają na długo. Ponadto dzieci wykształcają bardzo trwałe nawyki i przekonania, których zmiana w przyszłości może być niemałym wyzwaniem, dlatego tak ważne jest ich odpowiednie wychowanie i kształcenie.
Nie oznacza to jednak, że w dorosłym wieku nie mamy szansy na nauczenie się czegoś nowego czy rozwinięcie jakiejś pasji od samego początku. Podejmowanie takich wyzwań jest wręcz wskazane, ponieważ stanowi jeden z czynników, które poprawiają plastyczność mózgu i zdolności intelektualne w późniejszym wieku.
Neuroprzekaźniki
Spośród neuroprzekaźników w proces neurogenezy zaangażowane są przede wszystkim glutaminian, serotonina, noradrenalina, dopamina, acetylocholina oraz GABA. Glutaminian i GABA mają zdolność do wpływania na neurogenezę na wszystkich jej etapach [1].
Udział serotoniny i dopaminy w neurogenezie oznacza, że stany ich niedoboru w depresji lub w wyniku stosowania substancji psychoaktywnych (amfetamina, kokaina, MDMA) obniżają tempo neurogenezy. Oznacza to też, że leki stosowane w depresji zwiększają je. Regulując poziom serotoniny, dopaminy, a także acetylocholiny w naszym mózgu za pomocą leków lub suplementów (takich jak tryptofan, tyrozyna czy cholina) możemy więc istotnie poprawić naszą neurogenezę [1].
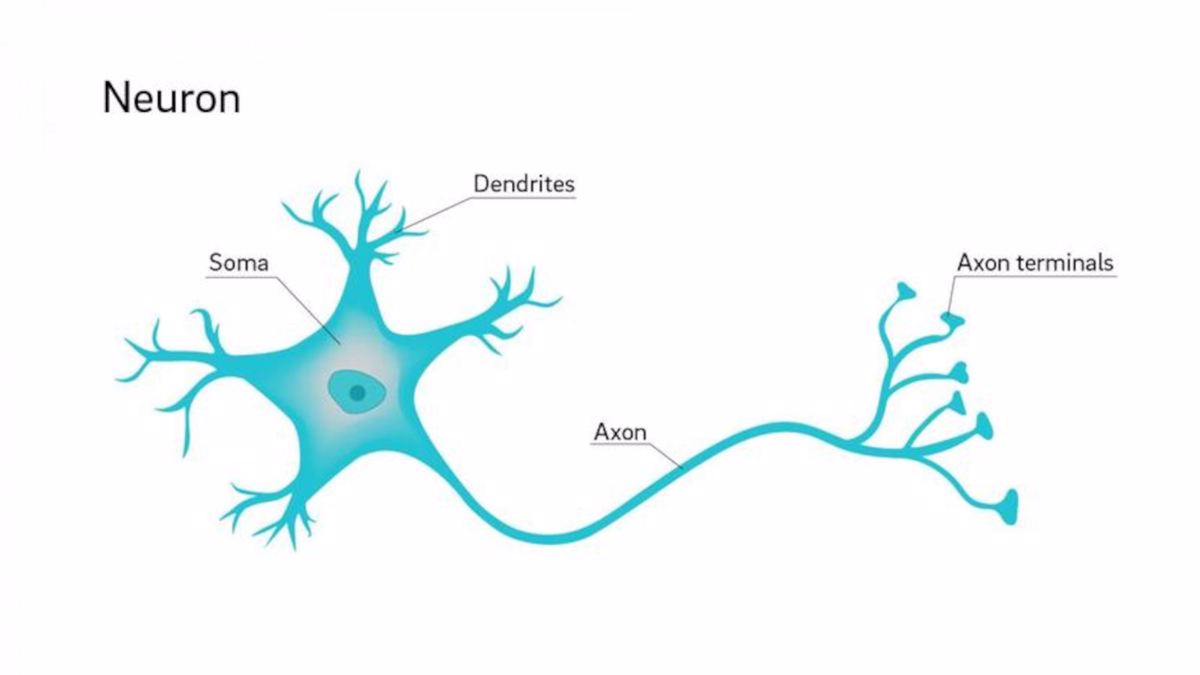
Cząsteczka serotoniny
Hormony
Neurogeneza warunkowana jest także przez hormony. Pozytywny wpływ na jej tempo mają: estrogen, testosteron i prolaktyna. W badaniach na zwierzętach wykazano, że u ciężarnych myszy neurogeneza może przyspieszyć aż o 65% [1, 5].
Negatywny wpływ na jej przebieg mają natomiast hormony stresu, czyli te należące do grupy glikokortykosteroidów (np. kortyzol). Nietrudno zatem wywnioskować, że stres działa na neurogenezę hamująco. Mało tego, uznawany jest za jeden z trzech najsilniejszych czynników hamujących neurogenezę. Obok niego stoi wiek i alkohol. Regularne podawanie szczurom kortykosteronu (zwierzęcy odpowiednik kortyzolu) poskutkowało zredukowaniem proliferacji neuronalnych komórek macierzystych i pogorszeniem kondycji nowo powstałych neuronów [1, 6].
Negatywny wpływ na przebieg neurogenezy mają natomiast hormony stresu, czyli te należące do grupy glikokortykosteroidów (np. kortyzol). Nietrudno zatem wywnioskować, że stres działa na neurogenezę hamująco. Mało tego, uznawany jest za jeden z trzech najsilniejszych czynników hamujących neurogenezę.
Uszkodzenia mózgu
Co ciekawe, bardzo intensywnie na podziały neuronalnych komórek macierzystych i przeżywalność nowych neuronów wpływają sytuacje patologiczne, takie jak nagły stan zapalny, udar lub napad padaczki. Nowe neurony migrują do uszkodzonych fragmentów mózgu i tam są wbudowywane. Zwiększa się też unaczynienie takich miejsc. Proces naprawczy może trwać nawet do kilku miesięcy po wystąpieniu uszkodzenia, a jego efektywność uzależniona jest od stanu, w jakim znajdował się mózg w momencie uszkodzenia, czyli od wieku, poziomu neuroprzekaźników i poziomu hormonów. Nie zawsze jednak procesy pozytywne przeważają nad negatywnymi: padaczka na przykład powoduje zwiększoną umieralność neuronów, a chroniczny stan zapalny i wiążący się z nim podniesiony poziom cytokin prozapalnych wpływa na neurogenezę hamująco [1].
Sprawdź również: